Обязательная маркировка лекарственных препаратов для медицинского применения
Все лекарственные препараты производимые или ввозимые на территорию Российской Федерации подлежат обязательной маркировки идентификационными знаками с 01.07.2020.
Под лекарственными препаратами понимаются лекарственные средства, которые применяются для профилактики диагностики, лечения заболевания, реабилитации, для сохранения, предотвращения или прерывания беременности[1].
По состоянию на 21.07.2020 в национальной системе цифровой маркировки и прослеживаемости продукции «Честный ЗНАК» (в рамках маркировки лекарственных препаратов) зарегистрировано 68 641 участников и выпущено 1 943 505 674 кодов маркировки[2].
Содержание
- 1 Правила обращения лекарственных препаратов в Евразийском экономическом союзе (ЕЭАС)
- 2 Про эксперимент
- 3 Лекарственные препараты, подлежащие обязательной маркировке
- 4 На какие лекарственные препараты не нужно наносить средства идентификации?
- 5 Про средства идентификации
- 6 Получение кодов маркировки и нанесение средств идентификации
- 7 Сроки нанесения средств идентификации
- 8 Ввод и вывод из оборота лекарственных препаратов
- 9 Примечания
- 10 См. также
Правила обращения лекарственных препаратов в Евразийском экономическом союзе (ЕЭАС)
Пока что на территории ЕАЭС не принято нормативных актов, которые регулировали бы процесс маркировки идентификационными знаками лекарственных препаратов. Однако 24.06.2019 председателю Коллегии Евразийской экономической комиссии было направлено письмо с инициативой о введении единой системы маркировки лекарственных препаратов в ЕАЭС[3]. С данной инициативой выступили: Ассоциации международных фармацевтических производителей в Российской Федерации, Республике Казахстан и Республике Беларусь, Ассоциация Российских Фармацевтических производителей, Союз Профессиональных Фармацевтических Организаций и Национальная ассоциация производителей фармацевтической продукции и медицинских изделий.
В данном письме идет речь о необходимости выработать и закрепить единые подходы и стандарты к цифровой маркировки лекарственных препаратов на территории ЕАЭС (так как разные государства-члены ЕАЭС планируют или же уже реализуют проекты по маркировки лекарственных препаратов).
Про эксперимент
В период с 01.02.2017 по 31.12.2019 на территории РФ проводился эксперимент по маркировке контрольными (идентификационными) знаками и мониторингу за оборотом отдельных видов лекарственных препаратов для медицинского применения[4].
До 31.10.2018 оператором информационной системы, осуществляющим информационное обеспечение проведения эксперимента, выступала Федеральная налоговая служба, а с 01.11.2018 таким оператором выступало уже ООО "Оператор-ЦРПТ".
В приоритете в эксперименте принимали участия лекарственные препараты, предназначенные для обеспечения лиц, больных: гемофилией, муковисцидозом, гипофизарным нанизмом, болезнью Гоше, злокачественными новообразованиями лимфоидной, кроветворной и родственных им тканей, рассеянным склерозом, лиц после трансплантации органов и (или) тканей.
Цели внедрения маркировки[5]:
- противодействие незаконному производству лекарственных препаратов;
- противодействие незаконному ввозу лекарственных препаратов;
- противодействие незаконному обороту лекарственных препаратов;
- противодействие недобросовестной конкуренции в сфере оборота лекарственных препаратов;
- стандартизация и унификация процедур учета поставок и распределения лекарственных препаратов, в том числе закупаемых для государственных нужд.
Цели эксперимента[6]:
- защитить население от фальсифицированных лекарственных препаратов;
- оперативно вывести из оборота контрафактные и недоброкачественные препараты;
- определить эффективность и результативность разрабатываемой системы контроля за движением на территории РФ лекарственных препаратов от производителя
либо импортера до конечного потребителя в целом, и каждого из участников рынка лекарственных препаратов в отдельности;
- выявить необходимость доработки законодательства РФ в сфере обращения лекарственных препаратов;
- определить технические возможности информационной системы взаимодействия участников оборота и органов исполнительной власти.
В эксперименте участвовали предприятия «Биокад», AstraZeneca, Stada CIS и ряд крупных российских аптек[7].
Согласно разработанным методическим рекомендациям[8] выделен следующий круг субъектов обращения лекарственных препаратов[9] в рамках эксперимента:
- российские производители лекарственных препаратов, которые осуществляют фасовку или упаковку лекарственных препаратов во вторичную (а при ее отсутствии в первичную упаковку) и/или третичную упаковку;
- российские производители лекарственных препаратов, которые осуществляют выпускающий контроль качества;
- российские и иностранные держатели регистрационных удостоверений лекарственных препаратов;
- представительства иностранных держателей регистрационных удостоверений лекарственных препаратов (РУ ЛП), зарегистрированные в установленном порядке в государственном реестре аккредитованных филиалов, представительств иностранных юридических лиц ФНС России;
- организации оптовой торговли лекарственных препаратов;
- организации розничной торговли лекарственных препаратов;
- медицинские организации.
Лекарственные препараты, подлежащие обязательной маркировке
Средства идентификации наносятся на все лекарственные препараты, за исключением установленного перечня.
При этом под лекарственными препаратами понимаются лекарственные средства, которые применяются для профилактики диагностики, лечения заболевания, реабилитации, для сохранения, предотвращения или прерывания беременности[10].
В свою очередь лекарственные средства — это вещества или их комбинации, которые вступают в контакт с организмом человека или животного, проникают в органы, ткани организма. Данные вещества применяются для профилактики, диагностики, лечения заболевания, реабилитации, для сохранения, предотвращения или прерывания беременности и получены из крови, плазмы крови, из органов, тканей организма человека или животного, растений, минералов методами синтеза или с применением биологических технологий[11].
Таким образом, все лекарственные препараты, которые так или иначе влияют на наш организм, а также на организмы животных подлежат обязательной маркировке
На какие лекарственные препараты не нужно наносить средства идентификации?
Перечень таких препаратов содержится в статьях Федерального закона «Об обращении лекарственных средств»[12]:
- лекарственные препараты, производимые для проведения клинических исследований,
- пиявки медицинские;
- лекарственные препараты, изготовленные аптечными организациями, ветеринарными аптечными организациями, индивидуальными предпринимателями, которые имеют лицензию на фармацевтическую деятельность, по рецептам на лекарственные препараты и требованиям медицинских организаций, ветеринарных организаций;
- лекарственные препараты, приобретенные физическими лицами за пределами РФ и предназначенные для личного использования;
- лекарственные препараты, ввозимые в РФ для оказания медицинской помощи по жизненным показаниям конкретного пациента на основании выданного разрешения;
- лекарственные средства, ввозимые в РФ на основании выданного разрешения и предназначенные для проведения клинических исследований лекарственных препаратов и (или) проведения экспертизы лекарственных средств для осуществления государственной регистрации лекарственных препаратов;
- фармацевтические субстанции;
- радиофармацевтические лекарственные препараты, изготовленные непосредственно в медицинских организациях в установленном порядке;
- лекарственные препараты, производимые для экспорта;
- лекарственные препараты, которые предназначены для применения в условиях военных действий, чрезвычайных ситуаций;
- лекарственные препараты, которые предназначены для профилактики и лечения заболеваний и поражений, полученных в результате воздействия неблагоприятных химических, биологических, радиационных факторов;
- лекарственные препараты, которые разработаны по заданию федеральных органов исполнительной власти.
Про средства идентификации
Средства идентификации наносятся в виде двухмерного штрихового кода DataMatrix и имеет следующую структуру:
1-я группа состоит из 14 цифр и содержит глобальный идентификационный номер торговой единицы, которому предшествует идентификатор применения (01);
2-я группа состоит из 13 символов (цифровой или буквенно-цифровой последовательности латинского алфавита) и содержит индивидуальный серийный номер торговой единицы, которому предшествует идентификатор применения (21);
3-я группа состоит из 4 символов (цифр, строчных и прописных букв латинского алфавита) и содержит идентификатор (индивидуальный порядковый номер) ключа проверки, предоставляемый субъектам оборота лекарственных препаратов оператором системы мониторинга в составе кода проверки, которому предшествует идентификатор применения (91).
4-я группа состоит из 44 символов (цифр, строчных и прописных букв латинского алфавита, а также специальных символов) и содержит значение кода проверки, предоставляемое субъектам оборота лекарственных препаратов оператором системы мониторинга в составе кода проверки, которому предшествует идентификатор применения (92).
Код DataMatrix наносится методами печати на вторичную (потребительскую) упаковку лекарственного препарата (а если она не предусмотрена, то на первичную упаковку лекарственного препарата) или печати на материальный носитель (этикетку), не допускающими отделения материального носителя, содержащего средства идентификации, от упаковки лекарственного препарата без повреждений.
При этом под первичной упаковкой понимается средство либо комплекс средств, обеспечивающих защиту лекарственных препаратов от повреждения и потерь, воздействия окружающей среды, загрязнений и имеющих непосредственный контакт с лекарственными препаратами, а под вторичной (потребительской) упаковкой понимается упаковка, поступающая к потребителю и служащая для размещения единичной первичной упаковки или объединяющая несколько первичных упаковок.
Стоимость кода маркировки определена Постановлением Правительства Российской Федерации от 8.05.2019 № 577[13] и составляет 50 копеек без учета НДС. Исключение - лекарственные препараты для медицинского применения, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов для медицинского применения, предельная отпускная цена производителя которых не превышает 20 рублей. Для таких товаров плата за коды маркировки не взимается.
Код идентификации третичной (транспортной) упаковки лекарственного препарата содержит следующую структуру данных:
- идентификатор применения (00);
- символ расширения кода идентификации третичной (транспортной) упаковки лекарственного препарата;
- регистрационный номер субъекта обращения лекарственных средств;
- серийный номер третичной (транспортной) упаковки лекарственного препарата;
- контрольная сумма (число, вычисляемое по специальному алгоритму из предшествующих цифр и служащее для гарантии целостности данных).
Код идентификации третичной (транспортной) упаковки лекарственного препарата генерируется и наносится на третичную (транспортную) упаковку лекарственного препарата методами печати или этикетирования.
Данный код представляет собой линейный штриховой код с фиксированной длинной в 18 знаков. С помощью кода идентификации третичной (транспортной) упаковки субъекты оборота лекарственных средств могут осуществлять приемку и передачу лекарственных препаратов, в рамках взаимодействия с другими контрагентами.
При этом под третичной (заводской, транспортной) упаковкой понимается групповая упаковка, используемая для хранения, перевозки и перемещения лекарственных препаратов между субъектами обращения и объединяющая произвольные наборы вторичных (потребительских) упаковок или третичных (заводских, транспортных) упаковок.
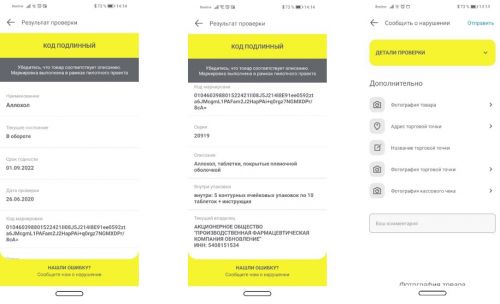
С помощью мобильного приложения Честный ЗНАК каждый потребитель может отсканировать код маркировки и проверить подлинность приобретаемой продукции. Ему будет доступна информация о составе, сроке годности, кратком описании, составе упаковки, коде маркировке, серии, владельце.
Кроме того, при выявленном нарушении потребитель сможет об этом сообщить, используя тоже самое мобильное приложение (сфотографировать товар и отправить результат проверки в систему «Честный ЗНАК»).
Получение кодов маркировки и нанесение средств идентификации
Про то, какое оборудование необходимо для работы в национальной системе цифровой маркировки и прослеживаемости продукции «Честный ЗНАК», а также как начать работать в системе можно узнать из статьи Обязательная маркировка товаров. Система «Честный ЗНАК».
Ниже представлен порядок действий по получению кодов маркировки и нанесению средств идентификации на лекарственные препараты:
1. Субъект обращения лекарственных средств регистрирует лекарственные препараты в системе мониторинга.
2. Субъект обращения лекарственных средств направляет оператору заявку на получение кодов маркировки.
3. Оператор формирует код маркировки и включает его в реестр средств идентификации.
4. Оператор в течение 2х часов с момента получения заявки направляет субъекту обращения лекарственных средств списки сформированных кодов маркировки.
5. Субъект обращения лекарственных средств преобразует коды маркировки в средства идентификации и обеспечивает их нанесение на вторичную (потребительскую) упаковку лекарственного препарата (а если она не предусмотрена, то на первичную упаковку лекарственного препарата) или на материальный носитель (этикетку) и не позднее даты ввода в оборот лекарственного препарата, или не позднее даты доставки лекарственных препаратов в место прибытия на территории РФ, или до даты ввоза на территорию РФ на фармацевтический склад лекарственных препаратов.
6. Если услуга по предоставлению кода маркировки не подлежит оплате, субъект обращения лекарственных средств после получения кода маркировки преобразует его в средство идентификации, обеспечивает его нанесение на вторичную (потребительскую) упаковку лекарственного препарата (а если она не предусмотрена, то на первичную упаковку лекарственного препарата) или на материальный носитель (этикетку) в течение 180 календарных дней, но не позднее вышеуказанных дат.
Сроки нанесения средств идентификации
С 01.07.2020 является обязательным нанесение средств идентификации на первичную упаковку лекарственного препарата (в случае, если вторичная упаковка не предусмотрена) и на вторичную (потребительскую) упаковку лекарственного препарата.
Также установлены сроки, в течение которых субъекты обращения лекарственных средств должны совершить следующие действия:
Действие |
Срок |
|---|---|
Зарегистрироваться в системе мониторинга движения лекарственных препаратов для медицинского применения |
С 01.01.2020 по 29.02.2020 либо в течение 7 календарных дней со дня возникновения необходимости по вводу в оборот/реализации товаров |
Обеспечить готовность программно-аппаратных средств к информационному взаимодействию с информационной системой мониторинга и направить заявку на прохождение тестирования |
В течение 21 дня со дня регистрации |
Пройти тестирование информационного взаимодействия программно-аппаратных средств и информационной системы мониторинга |
В течение 2 месяцев со дня готовности |
Ввод и вывод из оборота лекарственных препаратов
Ввод лекарственных препаратов в оборот |
при производстве на территории РФ — операции, производимые с лекарственными препаратами от прохождения производственной стадии фасовки (упаковки) лекарственных препаратов до завершения производственной стадии выпускающего контроля качества |
при производстве вне территории РФ (за исключением лекарственных препаратов, ввозимых из государств-членов ЕАЭС) — операции, производимые с лекарственными препаратами от прохождения производственной стадии выпускающего контроля до завершения таможенной процедуры выпуска для внутреннего потребления | |
при производстве вне территории РФ в отношении лекарственных препаратов, ввозимых из государств-членов ЕАЭС, — операции, производимые с лекарственными препаратами от прохождения производственной стадии выпускающего контроля до размещения лекарственных препаратов на фармацевтическом складе и прохождения процедур подтверждения соответствия лекарственных препаратов | |
Вывод лекарственных препаратов из оборота |
реализация, продажа и отпуск (в том числе по рецепту) лекарственных препаратов потребителю |
применение, передача на уничтожение, утрата и списание лекарственных препаратов | |
отбор образцов, вывоз ранее ввезенных в РФ лекарственных препаратов (реэкспорт), а также вывод из оборота по иным причинам |
Примечания
- ↑ [1] "Методические рекомендации для участников эксперимента по маркировке средствами идентификации и мониторингу за оборотом отдельных видов лекарственных препаратов для медицинского применения" (утв. Минздравом России 23.04.2018)
- ↑ [2] Маркировка лекарств
- ↑ Исх. №24/19 от 24 июня 2019 г. «О введении системы маркировки лекарственных препаратов в Евразийском экономическом союзе»
- ↑ [3] Постановление Правительства РФ от 24.01.2017 N 62 (ред. от 07.08.2019) "О проведении эксперимента по маркировке контрольными (идентификационными) знаками и мониторингу за оборотом отдельных видов лекарственных препаратов для медицинского применения" (вместе с "Положением о проведении эксперимента по маркировке контрольными (идентификационными) знаками и мониторингу за оборотом отдельных видов лекарственных препаратов для медицинского применения").
- ↑ [4] Постановление Правительства РФ от 24.01.2017 N 62 (ред. от 07.08.2019) "О проведении эксперимента по маркировке контрольными (идентификационными) знаками и мониторингу за оборотом отдельных видов лекарственных препаратов для медицинского применения" (вместе с "Положением о проведении эксперимента по маркировке контрольными (идентификационными) знаками и мониторингу за оборотом отдельных видов лекарственных препаратов для медицинского применения").
- ↑ [5] Постановление Правительства РФ от 24.01.2017 N 62 (ред. от 07.08.2019) "О проведении эксперимента по маркировке контрольными (идентификационными) знаками и мониторингу за оборотом отдельных видов лекарственных препаратов для медицинского применения" (вместе с "Положением о проведении эксперимента по маркировке контрольными (идентификационными) знаками и мониторингу за оборотом отдельных видов лекарственных препаратов для медицинского применения").
- ↑ [6] Маркировка на будущее
- ↑ [7] "Методические рекомендации для участников эксперимента по маркировке средствами идентификации и мониторингу за оборотом отдельных видов лекарственных препаратов для медицинского применения" (утв. Минздравом России 23.04.2018)
- ↑ Субъекты обращения лекарственных препаратов — юридические лица и индивидуальные предприниматели, которые осуществляют производство, хранение, ввоз в РФ, отпуск, реализацию, передачу, применение или уничтожение лекарственных препаратов
- ↑ [8] "Методические рекомендации для участников эксперимента по маркировке средствами идентификации и мониторингу за оборотом отдельных видов лекарственных препаратов для медицинского применения" (утв. Минздравом России 23.04.2018)
- ↑ [9] "Методические рекомендации для участников эксперимента по маркировке средствами идентификации и мониторингу за оборотом отдельных видов лекарственных препаратов для медицинского применения" (утв. Минздравом России 23.04.2018)
- ↑ [10] Федеральный закон от 12.04.2010 N 61-ФЗ (ред. от 02.08.2019) "Об обращении лекарственных средств"
- ↑ [11] Постановление Правительства РФ от 08.05.2019 N 577 "Об утверждении размера платы за оказание услуг по предоставлению кодов маркировки, необходимых для формирования средств идентификации и обеспечения мониторинга движения товаров, подлежащих обязательной маркировке средствами идентификации, а также о порядке ее взимания"
См. также
- Маркировка обуви: порядок, сроки, требования
- Обязательная маркировка табачной продукции
- Обязательная маркировка духов и туалетной воды
- Правила маркировки продукции
- Единый знак соответствия «ЕАС»
- Обязательная маркировка товаров. Система «Честный ЗНАК»
- Обязательная маркировка товаров легкой промышленности
- Обязательная маркировка фотокамер, фотовспышек и ламп-вспышек
| Энциклопедия IFCG — открытый информационный ресурс для участников и экспертов в области ВЭД.
В частности, мы готовы оказать Вам следующие услуги в рамках подтверждения соответствия техническим регламентам ТС/ЕАЭС: |